Развитие коллатералей. Коллатеральное коронарное кровообращение
Давно было замечено, что при выключении сосудистой магистрали кровь устремляется по окольным путям - коллатералям и питание отключенной части тела восстанавливается. Основным источником развития коллатералей являются анастомозы сосудов. Степень развития анастомозов и возможности их преобразования в коллатерали определяют пластические свойства (потенциальные возможности) сосудистого русла конкретной области тела или органа. В тех случаях, когда предсуществующих анастомозов для развития коллатерального кровообращения недостаточно, возможно новообразование сосудов. Однако роль новообразованных сосудов в процессе компенсации нарушенного кровотока очень незначительна.
Кровеносная система обладает огромными резервными возможностями, высокой приспособляемостью к изменившимся функциональным условиям. Так при наложении у собак лигатуры на обе сонные и позвоночные артерии не наблюдалось заметного нарушения деятельности мозга. В других опытах на собаках накладывалось до 15 лигатур на крупные артерии, включая брюшную аорту, но животные не погибали. Безусловно смертельной оказалась лишь перевязка брюшной аорты выше начала почечных артерий, венечных артерий сердца, брыжеечных артерий и легочного ствола.
Сосудистые коллатерали могут быть внеорганными и внутриорганными. Внеорганными коллатералями являются крупные, анатомически определенные анастомозы между ветвями артерий, снабжающих ту или иную часть тела или орган, или между крупными венами. Различают межсистемные анастомозы, которые связывают разветвления одного сосуда и ветвями другого сосуда, и внутрисистемные анастомозы, образующиеся между ветвями одного сосуда.
Внутриорганные анастомозы образуются между сосудами мышц, стенок полых органов, в паренхиматозных органах. Источниками развития коллатералей служат также сосуды подкожной основы, околососудистое и околонервное русло, образуемое артериями и венами, которые проходят рядом с крупными сосудами и нервными стволами.
Уставлено, что развитие макроскопически видимых коллатералей после окклюзии магистральных артерий происходит лишь через 20-30 дней, после окклюзии магистральных вен - через 10-20 дней. Однако восстановление функции органа при коллатеральном кровообращении наступает гораздо раньше, чем появление макроскопически видимых коллатералей. Было показано, что в ранние сроки после окклюзии магистральных стволов важная роль в развитии коллатерального кровообращения принадлежит гемомикроциркуляторному руслу. При артериальном коллатеральном кровообращении на основе артериоло-артериолярных анастомозов формируются микрососудистые артериолярные коллатерали, при венозном коллатеральном кровообращении на основе венуло-венулярных анастомозов образуются микрососудистые венулярные коллатерали. Именно они обеспечивают сохранение жизнеспособности органов в ранние сроки после окклюзии магистральных стволов. В последующем, в связи с выделением главных артериальных или венозных коллатералей, роль микрососудистых коллатералей постепенно снижается.
В результате многочисленных исследований были установлены стадии развития окольных путей кровотока:
Вовлечение в окольный кровоток максимального количества анастомозов, существующих в зоне окклюзии магистрального сосуда (ранние сроки - до 5 суток).
Преобразование артериоло-артериолярных или венуло-венулярных анастомозов в микрососудистые коллатерали, преобразование артерио-артериальных или вено-венозных анастомозов в коллатерали (от 5 суток до 2 месяцев).
Дифференцировка главных окольных путей кровотока и редукция микрососудистых коллатералей, стабилизация коллатерального кровообращения в новых условиях гемодинамики (от 2 до 8 месяцев).
Продолжительность второй и третьей стадии при артериальном коллатеральном кровообращении по сравнению с венозным больше на 10-30 суток, что свидетельствует о более высокой пластичности венозного русла.
Признаками сформировавшихся сосудов - коллатералей являются: равномерное расширение просвета на протяжении всего анастомоза; крупноволнистая извилистость; преобразование сосудистой стенки (утолщение за счет эластических компонентов).
Большая роль в развитии коллатерального кровообращения принадлежит нервной системе. Нарушение афферентной иннервации сосудов (деафферентация) вызывает стойкое расширение артерий. С другой стороны, сохранение афферентной и симпатической иннервации позволяет нормализовать восстановительные реакции, коллатеральное кровообращение при этом оказывается более эффективным.
КОЛЛАТЕРАЛИ СОСУДИСТЫЕ (лат. collateralis боковой) - боковые, или окольные, пути тока крови в обход главного магистрального сосуда, функционирующие в случае прекращения или затруднения кровотока в нем, обеспечивающие кровообращение как в артериальной, так и венозной системах. Существуют К. с. и в лимфатической системе (см.). Коллатеральным обычно принято обозначать кровообращение через сосуды того же типа, к-рому соответствуют сосуды с прерванным кровотоком. Так, при перевязке артерии коллатеральное кровообращение развивается по артериальным анастомозам, при сдавлении вен - по другим венам.
В обычных условиях жизнедеятельности организма в сосудистой системе функционируют анастомозы, соединяющие между собой ветви крупной артерии или притоки крупной вены. При нарушении кровотока в основных магистральных сосудах или их ветвях К. с. приобретают особое, компенсаторное, значение. После закупорки либо сдавления артерий и вен при некоторых патол, процессах, после перевязки или иссечения кровеносных сосудов во время операции, а также при врожденных пороках развития кровеносных сосудов К. с. или развиваются из существующих (предсуществующих) анастомозов, или образуются заново.
Начало широким экспериментальным исследованиям окольного кровообращения было положено в России Н. И. Пироговым (1832). В дальнейшем они развивались С. П. Коломниным, В. А. Оппелем и его школой, В.Н. T очковым и его школой. В.Н. Тонковым создано учение о пластичности кровеносных сосудов, включающее представление о физиол, роли К. с. и об участии нервной системы в процессе их развития. Большой вклад в изучение К. с. в венозной системе внесен школой В.Н. Шевкуненко. Известны также работы зарубежных авторов - Э. Купера, Р. Лериша, Нотнагеля, Порты (С. W. Н. Nothnagel, 1889; L. Porta, 1845). Порта в 1845 г. описал развитие новых сосудов между концами прерванной магистрали («прямые коллатерали») либо между ее ветвями, ближайшими к месту перерыва («непрямые коллатерали»).
По месту расположения различают К. с. Внеорганные и внутриорганные. Внеорганные соединяют ветви крупных артерий или притоки крупных вен в пределах бассейна разветвления данного сосуда (внутрисистемные К. с.) либо переводят кровь из разветвлений или притоков других сосудов (межсистемные К. с.). Так, в пределах бассейна наружной сонной артерии внутрисистемные К. с. образуются за счет соединений различных ее ветвей; межсистемные К. с. формируются из анастомозов этих ветвей с ветвями из систем подключичной артерии и внутренней сонной артерии. Мощное развитие межсистемных артериальных К. с. может в течение десятков лет жизни обеспечивать нормальное кровоснабжение организма даже при врожденной коарктации аорты (см.). Примером межсистемных К. с. в пределах венозной системы являются сосуды, развивающиеся из портокавальных анастомозов (см.) в области пупка (caput medusae) при циррозе печени.
Внутриорганные К. с. образованы сосудами мышц, кожи, кости и надкостницы, стенок полых и паренхиматозных органов, vasa vasorum, vasa nervorum.
Источником развития К. с. является также обширное околососудистое добавочное русло, состоящее из мелких артерий и вен, располагающихся рядом с соответствующими более крупными сосудами.
Слои стенки кровеносных сосудов, превращающихся в К. с., претерпевают сложную перестройку. Происходит разрыв эластических мембран стенки с последующими репаративными явлениями. Этот процесс затрагивает все три оболочки стенки сосуда и достигает оптимального развития к концу первого месяца после начала развития К. с.
Одним из видов формирования коллатерального кровообращения в условиях патологии является образование спаек с новообразованием в них сосудов. Посредством этих сосудов устанавливаются соединения между сосудами тканей и органов, спаянных друг с другом.
Среди причин развития К. с. после оперативного вмешательства прежде всего называли повышение давления выше места перевязки сосуда. Ю. Конгейм (1878) придавал значение нервным импульсам, возникающим во время операции перевязки сосуда и после нее. Б. А. Долго-Сабуровым установлено, что любое оперативное вмешательство на сосуде, вызывающее местное нарушение кровотока, сопровождается травмой его сложного нервного аппарата. Это мобилизует компенсаторные механизмы сердечно-сосудистой системы и нервной регуляции ее функций. При остро наступающей непроходимости магистральной артерии расширение коллатеральных сосудов зависит не только от гемодинамических факторов, но связано ис нервно-рефлекторным механизмом - падением тонуса сосудистой стенки.
В условиях хрон, патол, процесса, при медленно развивающемся затруднении кровотока в разветвлениях магистральной артерии создаются более благоприятные условия для постепенного развития К. с.
Формирование новообразованных К. с., по данным Рейхерта (С. Reichert), в основном заканчивается в сроки от 3-4 нед. до 60-70 дней после прекращения кровотока по магистральному сосуду. В дальнейшем происходит процесс «отбора» главных окольных путей, принимающих основное участие в кровоснабжении анемизированной области. Хорошо развитые предсуществующие К. с. могут обеспечить достаточное кровоснабжение уже с момента перерыва магистрального сосуда. Многие органы способны функционировать еще до наступления момента оптимального развития К. с. В этих случаях функц, реституция тканей наступает задолго до формирования морфологически выраженных К. с., по-видимому, за счет резервных путей микроциркуляции. Истинным критерием функц, достаточности развившихся К. с. должны служить показатели физиол, состояния тканей и их структуры в условиях окольного кровоснабжения. Эффективность коллатерального кровообращения зависит от следующих факторов: 1) объема (диаметра) коллатеральных сосудов коллатерали в области артерий более эффективны, чем прекапиллярные анастомозы; 2) характера обтурирующего процесса в основном сосудистом стволе и темпа наступления обтурации; после перевязки сосуда коллатеральное кровообращение формируется полнее, чем после тромбоза, в силу того что при образовании тромба одновременно могут обтурироваться крупные ветви сосуда; при постепенно наступающей обтурации К. с. успевают развиться; 3) функц, состояния тканей, т. е. их потребности в кислороде в зависимости от интенсивности процессов обмена (достаточность коллатерального кровообращения в состоянии покоя органа и недостаточность при нагрузке); 4) общего состояния кровообращения (показателей минутного объема артериального давления).
Коллатеральное кровообращение при повреждении и перевязке магистральных артерий
В практике хирургии, особенно военно-полевой, с проблемой коллатерального кровоснабжения приходится сталкиваться чаще всего при ранениях конечностей с повреждением их магистральных артерий и при последствии этих повреждений - травматических аневризмах, в тех случаях, когда наложение сосудистого шва оказывается невозможным и возникает необходимость выключения магистрального сосуда путем его перевязки. При ранениях и травматических аневризмах артерий, питающих внутренние органы, перевязка магистрального сосуда, как правило, применяется совместно с удалением соответствующего органа (напр., селезенки, почки), и вопрос о его коллатеральном кровоснабжении вообще не встает. Особое место занимает вопрос о коллатеральном кровообращении при перевязке сонной артерии (см. ниже).

Судьбу конечности, магистральная артерия к-рой выключена, определяют возможности кровоснабжения через К. с.- предсуществующие или новообразованные. Образование и функционирование тех или других настолько улучшает кровоснабжение, что может проявиться восстановлением отсутствовавшего пульса на периферии конечности. Б. А. ДолгоСабуров, В. Черниговский неоднократно подчеркивали, что функц, восстановление К. с. значительно опережает сроки морфол, преобразования коллатералей, поэтому в первое время ишемическая гангрена конечности может быть предотвращена только за счет функции предсуществующих К. с. Классифицируя их, Р. Лериш различает наряду с «первым планом» кровообращения конечности (сам магистральный сосуд) «второй план» - крупные, анатомически определяемые анастомозы между ветвями магистрального сосуда и ветвями второстепенного сосуда так наз. Внеорганные К. с. (на верхней конечности это поперечная артерия лопатки, на нижней - седалищная артерия) и «третий план» - очень мелкие, весьма многочисленные анастомозы сосудов в толще мышц (внутриорганные К. с.), соединяющие систему магистральной артерии с системой второстепенных артерий (рис. 1). Пропускная способность К. с. «второго плана» у каждого человека примерно постоянна: она велика при рассыпном типе ветвления артерий и часто недостаточна при магистральном типе. Проходимость же сосудов «третьего плана» зависит от их функц, состояния и у одного и того же субъекта может резко колебаться, их минимальная пропускная способность, по данным H. Бурденко и др., относится к максимальной как 1:4. Именно они служат основным, наиболее постоянным путем коллатерального кровотока и при ненарушенной функции, как правило, компенсируют отсутствие магистрального кровотока. Исключение составляют случаи, в которых магистральная артерия пострадала там, где конечность не имеет больших мышечных масс, и, следовательно, «третий план» кровообращения недостаточен анатомически. Это относится особенно к подколенной артерии. Функц, недостаточность К. с. «третьего плана» может быть вызвана рядом причин: обширной травмой мышц, их расслоением и сдавлением большой гематомой, распространенным воспалительным процессом, спазмом сосудов пострадавшей конечности. Последний нередко возникает в ответ на раздражения, исходящие из травмированных тканей, а особенно с концов поврежденного или ущемленного в лигатуре магистрального сосуда. Само снижение артериального давления на периферии конечности, магистральная артерия к-рой выключена, может вызвать спазм сосудов - их «адаптационную контрактуру». Но ишемическая гангрена конечности иногда развивается и при хорошей функции коллатералей в связи с явлениями описанного В. А. Оппелем так наз. венного дренажа: если при непроходимой артерии сопутствующая вена функционирует нормально, то кровь, поступающая из К. с., может уходить в венозную систему, не достигнув дистальных артерий конечности (рис. 2, а). В целях предотвращения венного дренажа перевязывают одноименную вену (рис. 2, б). Кроме того, на коллатеральное кровоснабжение отрицательно влияют такие факторы, как обильная кровопотеря (особенно из периферического конца поврежденного магистрального сосуда), нарушения гемодинамики, вызванные шоком, длительным общим охлаждением.
Оценка достаточности К. с. необходима для планирования объема предстоящей операции: наложение сосудистого шва, перевязка кровеносного сосуда или ампутация. В экстренных случаях при невозможности детального обследования критериями, однако не абсолютно надежными, служат окраска покровов конечности и ее температура. Для достоверного суждения о состоянии коллатерального кровотока перед операцией проводят пробы Короткова, Мошковича, основанные на измерении капиллярного давления; пробу Генле (степень кровотечения при уколе кожи стопы или кисти), производят капилляроскопию (см.), осциллографию (см.) и радиоизотопную диагностику (см.). Наиболее точные данные получают путем ангиографии (см.). Простым и надежным способом служит проба на утомляемость: если при пальцевом прижатии артерии у корня конечности больной может производить движения стопой или кистью более 2-2,5 мин., коллатерали достаточны (проба Русанова). Наличие явлений венного дренажа можно установить только во время операции по набуханию пережатой вены при отсутствии кровотечения из периферического конца артерии - признак вполне убедительный, но не постоянный.
Способы борьбы с недостаточностью К. с. делят на проводимые до операции, осуществляемые в ходе операции и применяемые после нее. В предоперационном периоде наибольшее значение имеют тренировка коллатералей (см.), футлярная или проводниковая новокаиновая блокада, Внутриартериальное введение 0,25-0,5% р-ра новокаина со спазмолитиками, внутривенное введение реополиглюкина.
На операционном столе при необходимости перевязки магистрального сосуда, проходимость к-рого не удается восстановить, применяют переливание крови в периферический конец выключаемой артерии, устраняющее адаптационную контрактуру сосудов. Впервые это было предложено Л. Я. Лейфером еще во время Великой Отечественной войны (1945). В последующем и в эксперименте, и в клинике метод был подтвержден рядом советских исследователей. Оказалось, что Внутриартериальное введение крови в периферический конец лигированной артерии (одновременно с компенсацией общей кровопотери) значительно изменяет гемодинамику коллатерального кровообращения: возрастает систолическое, а главное пульсовое давление. Все это способствует тому, что у некоторых больных даже после перевязки таких крупных магистральных сосудов, как подкрыльцовая артерия, подколенная артерия, появляется коллатеральный пульс. Эта рекомендация нашла применение в ряде клиник страны. Для предупреждения послеоперационного спазма К. с. рекомендована возможно более обширная резекция перевязываемой артерии, десимпатизация ее центрального конца на участке резекции, что прерывает центробежную вазоспастическую импульсацию. С этой же целью С. А. Русанов предложил дополнять резекцию круговым рассечением адвентиции центрального конца артерии вблизи лигатуры. Перевязка одноименной вены по Оппелю (создание «редуцированного кровообращения») - надежный способ борьбы с венным дренажем. Показания к этим оперативным приемам и их техника - см. Перевязка кровеносных сосудов .
Для борьбы с послеоперационной недостаточностью К. с., обусловленной спазмом сосудов, показана футлярная новокаиновая блокада (см.), Околопочечная блокада по Вишневскому, длительная перидуральная анестезия по Дольотти, особенно же блокада поясничных симпатических ганглиев, а для верхней конечности - звездчатого узла. Если блокада дала лишь временный эффект, следует применить поясничную (или шейную) симпатэктомию (см.). Связь послеоперационной ишемии с венным дренажем, не обнаруженным при операции, можно установить только с помощью ангиографии; в этом случае перевязку вены по Оппелю (вмешательство простое и малотравматичное) следует произвести дополнительно в послеоперационном периоде. Все эти активные мероприятия перспективны, если ишемия конечности не вызвана недостаточностью К. с. вследствие обширного разрушения мягких тканей или их тяжелой инфекции. Если же ишемия конечности вызвана именно этими факторами, следует, не теряя времени, ампутировать конечность.
Консервативное лечение недостаточности коллатерального кровообращения сводится к дозированному охлаждению конечности (делающему ткани более устойчивыми к гипоксии), массивным переливаниям крови, применению спазмолитиков, сердечных и сосудистых средств.
В позднем послеоперационном периоде при относительной (не приводящей к гангрене) недостаточности кровоснабжения может встать вопрос о восстановительной операции, протезировании перевязанного магистрального сосуда (см. Кровеносные сосуды, операции) или о создании искусственных коллатералей (см. Шунтирование кровеносных сосудов).
При повреждении и перевязке общей сонной артерии кровоснабжение головного мозга могут обеспечить только коллатерали «второго плана» - анастомозы со щитовидными и другими некрупными артериями шеи, главным же образом (а при выключении внутренней сонной артерии исключительно) позвоночные артерии и внутренняя сонная артерия противоположной стороны, через лежащий на основании мозга коллатеральный - виллизиев (артериальный) круг - circulus arteriosus. Если достаточность этих коллатералей не установлена заранее радиометрическим и ангиографическим исследованиями, то перевязка общей или внутренней сонной артерии, вообще грозящая тяжелыми мозговыми осложнениями, становится особенно рискованной.
Библиография: Аничков М. Н. и Лев И. Д. Клинико-анатомический атлас патологии аорты, Л., 1967, библиогр.; Булынин В. И. и Токпанов С. И. Двухэтапное лечение острой травмы магистральных сосудов, Хирургия, № 6, с. 111, 1976; Долго-Сабуров Б.А. Анастомозы и пути окольного кровообращения у человека, Л., 1956, библиогр.; он же, Очерки функциональной анатомии кровеносных сосудов, Л., 1961; К и-с e л e в В. Я. Pi К о м а р о в И. А. Тактика хирурга при тупой травме магистральных сосудов конечностей, Хирургия, № 8, с. 88, 1976; Князев М. Д., Комаров И. А. и К и с e л e в В. Я. Хирургическое лечение повреждений артериальных сосудов конечностей, там же, № 10, с. 144, 1975; К о в а н о в В. В. и Аникина Т. И, Хирургическая анатомия артерий человека, М., 1974, библиогр.; Корендясев М. А. Значение периферического кровотечения при операциях по поводу аневризм, Вестн, хир., т. 75, № 3, с. 5, 1955; Л e й т e с А. Л. и Ш и-д а к о в Ю. X. Пластичность кровеносных сосудов сердца и легких, Фрунзе, 1972, библиогр.; Л ыткинМ. И. и К о-л о м и e ц В. Г1. Острая травма магистральных кровеносных сосудов, Л., 1973, библиогр.; Оппель В. А. Колляте-ральное кровообращение, Спб., 1911; Петровский Б. В. Хирургическое лечение ранений сосудов, М., 1949; Пирогов Н. И. Является ли перевязка брюшной аорты при аневризме паховой области легко выполнимым и безопасным вмешательством, М., 1951; Русанов С. А. О контроле результатов предоперационной тренировки коллятералей при травматических аневризмах, Хирургия, № 7, с. 8, 1945; T о н к о в В. Н. Избранные труды, Л., 1959; Шмидт Е. В. и др. Окклюзирующие поражения магистральных артерий головы и их хирургическое лечение, Хирургия, № 8, с. 3, 1973; Щелкунов С. И. Изменение эластической стромы стенки артерий при развитии коллятерального кровообращения, Арх. биол, наук, т. 37, в. 3, с. 591, 1935, библиогр.
Б. А. Долго-Сабуров, И. Д. Лев; С. А. Русанов (хир.).
Коллатеральное кровообращение есть важное функциональное приспособление организма, связанное с большой пластичностью кровеносных сосудов и обеспечивающее бесперебойное кровоснабжение органов и тканей. Глубокое изучение его, имеющее важное практическое значение, связано с именем В. Н. Тонкова и его школы (Р. А. Бардина, Б. А. Долго-Сабуров, В. В. Гинзбург, В. Н. Колесников, В. П. Курковский, В. П. Кунцевич, И. Д. Лев, Ф. В. Судзиловский, С. И. Щелкунов, М. В. Шепелев и др.).
Под коллатеральным кровообращением понимается боковой окольный ток крови, осуществляющийся по боковым сосудам. Он совершается в физиологических условиях при временных затруднениях кровотока (например, при сдавлении сосудов в местах движения, в суставах). Он может возникнуть и в патологических условиях - при закупорке, ранениях, перевязке сосудов при операциях и т. п.
В физиологических условиях окольный ток крови осуществляется по боковым анастомозам, идущим параллельно основным. Эти боковые сосуды называются коллатералями (например, a. collateralis ulnaris и др.), отсюда и название кровотока - окольное, или коллатеральное, кровообращение.
При затруднении кровотока по основным сосудам, вызванном их закупоркой, повреждением или перевязкой при операциях, кровь устремляется по анастомозам в ближайшие боковые сосуды, которые расширяются и становятся извитыми, сосудистая стенка перестраивается за счет изменения мышечной оболочки и эластического каркаса, и они постепенно преобразуются в коллатерали иного строения, чем в норме (Р. А. Бардина).
Таким образом, коллатерали существуют и в обычных условиях, и могут развиваться вновь при наличии анастомозов. Следовательно, при расстройстве обычного кровообращения, вызванном препятствием на пути тока крови в данном сосуде, вначале включаются существующие обходные кровеносные пути, коллатерали, а затем развиваются новые. В результате нарушенное кровообращение восстанавливается. В этом процессе важную роль играет нервная система (Р. А. Бардина, Н. И. Зотова, В. В. Колесников, И. Д. Лев, М. Г. Привес и др.).
Из изложенного вытекает необходимость четко определить разницу между анастомозами и коллатералями.
Анастомоз (anastomoo, греч. - снабжаю устьем) - соустье - это всякий третий сосуд, который соединяет два других, - понятие анатомическое.
Коллатераль (collateralis, лат. - боковой) - это боковой сосуд, осуществляющий окольный ток крови; понятие - анатомо-физиологическое.
Коллатерали бывают двух родов. Одни существуют в норме и имеют строение нормального сосуда, как и анастомоз. Другие развиваются вновь из анастомозов и приобретают особое строение.
Для понимания коллатерального кровообращения необходимо знать те анастомозы, которые, соединяют между собой системы различных сосудов, по которым устанавливается коллатеральный ток крови в случае ранений сосудов, перевязки при операциях и закупорки (тромбоз и эмболия).
Анастомозы между ветвями крупных артериальных магистралей, снабжающих основные части тела (аорта, сонные артерии, подключичные, подвздошные и т. п.) и представляющих как бы отдельные системы сосудов, называются межсистемными. Анастомозы между ветвями одной крупной артериальной магистрали, ограничивающиеся пределами ее разветвления, называются внутрисистемными.
Эти анастомозы уже отмечались по ходу изложения артерий.
Имеются анастомозы и между тончайшими внутриорганными артериями и венами - артерио-венозные анастомозы. По ним кровь течет в обход микроциркуляторного русла при его переполнении и, таким образом, образует коллатеральный путь, непосредственно соединяющий артерии и вены, минуя капилляры.
Кроме того, в коллатеральном кровообращении принимают участие тонкие артерии и вены, сопровождающие магистральные сосуды в сосудисто-нервных пучках и составляющие так называемое околососудистое и околонервное артериальное и венозное русло (А. Т. Акилова).
Анастомозы, кроме их практического значения, являются выражением единства артериальной системы, которую для удобства изучения мы искусственно разбиваем на отдельные части.
Вены большого круга кровообращения
Система верхней полой вены
Vena cava superior, верхняя полая вена , представляет собой толстый (около 2,5 см), но короткий (5-6 см) ствол, располагающийся справа и несколько сзади восходящей аорты. Верхняя полая вена образуется из слияния vv. brachiocephalicae dextra et sinistra позади места соединения I правого ребра с грудиной. Отсюда она спускается вниз вдоль правого края грудины позади первого и второго межреберных промежутков и на уровне верхнего края III ребра, скрывшись позади правого ушка сердца, вливается в правое предсердие. Задней своей стенкой она соприкасается с a. pulmonalis dextra, отделяющей ее от правого бронха, и на очень небольшом протяжении, у места впадения в предсердие, с верхней правой легочной веной; оба эти сосуда пересекают ее поперечно. На уровне верхнего края правой легочной артерии в верхнюю полую вену впадает v. azygos, перегнувшись через корень правого легкого (через корень левого легкого перегибается аорта). Передняя стенка верхней полой вены отделена от передней стенки грудной клетки довольно толстым слоем правого легкого.
Плечеголовные вены
Vv. brachiocephalicae dextra et sinistra, плечеголовные вены , из которых образуется верхняя полая вена, в свою очередь, получаются каждая путем слияния v. subclaviae и v. jugularis internae . Правая плечеголовная вена короче левой, всего 2-3 см длиной; образовавшись позади правого грудино-ключичного сочленения, она идет косо вниз и медиально к месту слияния с соименной веной левой стороны. Спереди правая плечеголовная вена прикрыта mm. sternocleidomastoideus, sternohyoideus и sternothyreoideus, а ниже хрящом I ребра. Левая плечеголовная вена приблизительно вдвое длиннее правой. Образовавшись позади левого грудино-ключичного сочленения, она направляется позади рукоятки грудины, отделенная от нее только клетчаткой и зобной железой, вправо и книзу к месту слияния с правой плечеголовной веной; тесно прилегая при этом своей нижней стенкой к выпуклости дуги аорты, она перекрещивает спереди левую подключичную артерию и начальные части левой общей сонной артерии и плечеголовного ствола. В плечеголовные вены впадают vv. thyreoideae inferiors et v. thyreoidea ima, образующиеся из густого венозного сплетения у нижнего края щитовидной железы, вены зобной железы, vv. vertebrates, cervicales et thoracicae internae.
Внутренняя яремная вена
V. jugularis interna, внутренняя яремная вена (рис. 239, 240), выносит кровь из полости черепа и органов шеи; начинаясь у foramen jugulare, в котором она образует расширение, bulbus superior venae jugularis internae, вена спускается вниз, располагаясь латерально от a. carotis interna и далее вниз латерально от a. carotis communis. На нижнем конце v. jugularis internae перед соединением ее с v. subclavia образуется второе утолщение - bulbus inferior v. jugularis internae; в области шеи выше этого утолщения в вене имеется один или два клапана. На своем пути в области шеи внутренняя яремная вена прикрыта mm. sternocleidomastoideus и omohyoideus. О синусах, изливающих кровь в v. jugularis interna, см. в отделе о головном мозге. Здесь нужно упомянуть о vv. ophthalmicae superior et inferior, которые собирают кровь из глазницы и вливаются в sinus cavernosus, причем v. ophthalmica inferior соединяется еще с plexus pterygoideus (см. ниже).

На своем пути v. jugularis interna принимает следующие притоки:
1. V. facialis, лицевая вена . Притоки ее соответствуют разветвлениям a. facialis.
2. V. retromandibularis , позадичелюстная вена , собирает кровь из височной области. Далее книзу в v. retromandibularis впадает ствол, выносящий кровь из plexus pterygoideus (густого сплетения между mm. pterygoidei), после чего v. retromandibularis, проходя через толщу околоушной железы вместе с наружной сонной артерией, ниже угла нижней челюсти сливается с v. facialis.
Наиболее коротким путем, связующим лицевую вену с крыловидным сплетением, является описанная М. А. Сресели "анастомотическая вена" (v. anastomotica facialis), которая расположена на уровне альвеолярного края нижней челюсти.
3. Vv. pharyngeae, глоточные вены , образуя на глотке сплетение (plexus pharyngeus), вливаются или непосредственно в v. jugularis interna, или же впадают в v. facialis.
4. V. lingualis, язычная вена , сопровождает одноименную артерию.
5. Vv. thyreoideae superiores, верхние щитовидные вены , собирают кровь из верхних участков щитовидной железы и гортани.
6. V. thyreoidea media, средняя щитовидная вена (вернее, lateralis, по Н. Б. Лихачевой), отходит от бокового края щитовидной железы и вливается в v. jugularis interna. У нижнего края щитовидной железы имеется непарное венозное сплетение - plexus thyreoideus impar, отток из которого происходит через vv. thyreoideae superiores в v. jugularis interna, а также no vv. thyreoideae inferiores и v. thyreoidea ima в вены переднего средостения.
Наружная яремная вена
V. jugularis externa, наружная яремная вена (см. рис. 239, 240 и 241), начавшись позади ушной раковины и выйдя на уровне угла челюсти из области позадичелюстной ямки, спускается, покрытая m. platysma, по наружной поверхности грудино-ключично-сосцевидной мышцы, пересекая ее наискось книзу и кзади. Достигнув заднего края грудино-ключично-сосцевидной мышцы, вена вступает в надключичную область, где впадает обычно общим стволом с v. jugularis anterior в подключичную вену. Позади ушной раковины в v. jugularis externa впадают v. auricularls posterior и v. occipitalis.

Передняя яремная вена
V. jugularis anterior, передняя яремная вена , образуется из мелких вен над подъязычной костью, откуда спускается вертикально вниз. Обе vv. jugulares anteriores, правая и левая, прободают глубокий листок fascia colli propriae, входят в spatium interaponeuroticum suprasternal и вливаются в подключичную вену. В надгрудинном промежутке обе vv. jugulares anteriores анастомозируют между собой одним или двумя стволами. Таким образом, над верхним краем грудины и ключицами образуется венозная дуга, так называемая drcus venosus jdgult. В некоторых случаях vv. jugulares anteriores заменяются одной непарной v. jugularis anterior, которая спускается по средней линии и внизу вливается в упомянутую венозную дугу, образующуюся в таких случаях из анастомоза между vv. jugulares externae (см. рис. 239).
Подключичная вена
V. subclavia, подключичная вена , представляет собой непосредственное продолжение v. axillaris. Она располагается кпереди и книзу от одноименной артерии, от которой отделена посредством m. scalenus anterior; позади грудино-ключичного сочленения подключичная вена сливается с v. jugularis interna, причем из слияния этих вен образуется v. brachiocephalica.
Вены верхней конечности
Вены верхней конечности разделяются на глубокие и поверхностные.
Поверхностные , или подкожные , вены, анастомозируя между собой, образуют широкопетлистую сеть, из которой местами обособляются более крупные стволы. Эти стволы следующие (рис. 242):

1. V. cephalica * начинается в лучевом отделе тыла кисти, по лучевой стороне предплечья достигает локтя, анастомозируя здесь с v. basilica , идет по sulcus bicipitalis lateralis, затем прободает фасцию и впадает в v. axillaris.
* (Головная вена, так как полагали, что при ее вскрытии кровь отвлекается от головы. )
2. V. basilica * начинается на локтевой стороне тыла кисти, направляется в медиальном отделе передней поверхности предплечья вдоль m. flexor carpi ulnaris к локтевому сгибу, анастомозируя здесь с v. cephalica через посредство v. mediana cubiti; далее ложится в sulcus bicipitalis medialis, прободает на половине протяжения плеча фасцию и вливается в v. brachialis.
* (Царская вена, так как ее вскрывали при болезнях печени, которую считали царицей тела. )
3. V. mediana cubiti, срединная вена локтевой области , представляет собой косо расположенный анастомоз, соединяющий в области локтя между собою v. basilica и v. cephalica. В нее обычно впадает v. mediana antebrdchii, несущая кровь с ладонной стороны кисти и предплечья. V. mediana ciibiti имеет большое практическое значение, так как служит местом для внутривенных вливаний лекарственных веществ, переливания крови и взятия ее для лабораторных исследований.
Глубокие вены сопровождают одноименные артерии, обычно по две каждую. Таким образом, имеются по две: vv. brachiales, ulnares, radiales, interosseae.
Обе vv. brachiales у нижнего края m. pectoralis major сливаются вместе и образуют подкрыльцовую вену, v. axillaris , которая в подкрыльцовой ямке лежит медиально и кпереди от одноименной артерии, отчасти прикрывая ее. Проходя под ключицей, она продолжается далее в виде v. subclavia. В v. axillaris, кроме указанной выше v. cephalica, впадает v. thoracoacromialis (соответствует одноименной артерии), v. thoracica lateralis (в которую часто впадает v. thoracoepigastrica, крупный ствол брюшной стенки), v. subscapularis, vv. circumflexae humeri .
Вены - непарная и полунепарная
V. azygos, непарная вена , и v. hemiazygos, полунепарная вена , образуются в брюшной полости из восходящих поясничных вен, vv. lumbdles ascendentes, соединяющих поясничные вены в продольном направлении. Они идут кверху позади m. psoas major и проникают в грудную полость между мышечными пучками ножки диафрагмы: v. azygos - вместе с правым n. splanchnicus, v. hemiazygos -с левым n. splanchnicus или симпатическим стволом.
В грудной полости v. azygos поднимается вдоль правой боковой стороны позвоночника, тесно прилегая к задней стенке пищевода. На уровне IV или V позвонка она отходит от позвоночника и, перегнувшись через корень правого легкого, впадает в верхнюю полую вену. Кроме ветвей, выносящих кровь из органов средостения, в непарную вену впадают девять правых нижних межреберных вен и через них - вены позвоночных сплетений. Вблизи места, где непарная вена перегибается через корень правого легкого, она принимает в себя v. intercostdlis superior dextra, образующуюся из слияния верхних трех правых межреберных вен (рис. 243).

На левой боковой поверхности тел позвонков позади нисходящей грудной аорты лежит v. hemiazygos. Она поднимается лишь до VII или VIII грудного позвонка, затем поворачивает вправо и, пройдя наискось кверху по передней поверхности позвоночника позади грудной аорты и ductus thoracicus, вливается в v. azygos. Она принимает в себя ветви из органов средостения и нижние левые межреберные вены, а также вены позвоночных сплетений. Верхние левые межреберные вены вливаются в v. hemiazygos accessoria, которая идет сверху вниз, располагаясь так же, как и v. hemiazygos, на левой боковой поверхности тел позвонков, и вливается либо в v. hemiazygos, либо непосредственно в v. azygos, перегнувшись вправо через переднюю поверхность тела VII грудного позвонка.
Вены стенок туловища
Vv. intercostales posteriores, задние межреберные вены , сопровождают в межреберных промежутках одноименные артерии по одной вене на каждую артерию. О впадении межреберных вен в непарную и полунепарную вены было сказано выше. В задние концы межреберных вен близ позвоночника впадают: ramus dorsalis (ветвь, несущая кровь из глубоких мышц спины) и ramus spinalis (из вен позвоночных сплетений).
V. thoracica interna, внутренняя грудная вена , сопровождает одноименную артерию; будучи двойной на большей части протяжения, она, однако, близ I ребра сливается в один ствол, который впадает в v. brachiocephaiica той же стороны.
Начальный отдел ее, v. epigastrica superior, анастомозирует с v. epigastrica inferior (вливается в v. iliaca externa), а также с подкожными венами живота (vv. subcutaneae abdominis), образующими крупнопетлистую сеть в подкожной ткани. Из этой сети кровь оттекает кверху через v. thoracoepigastrica et v. thoracica lateralis в v. axillaris, а книзу кровь течет через v. epigastrica superficialis и v. circumflexa ilium superficialis в бедренную вену. Таким образом, вены в передней брюшной стенке образуют непосредственное соединение областей разветвления верхней и нижней полых вен. Кроме того, в области пупка несколько венозных веточек соединяются при посредстве vv. paraumbilicales с системой воротной вены (об этом см. ниже).
Позвоночные сплетения

Имеются четыре венозных позвоночных сплетения - два внутренних и два наружных. Внутренние сплетения, plexus venosi vertebrates interni (anterior et posterior) расположены в позвоночном канале и состоят из ряда венозных колец, по одному на каждый позвонок. Во внутренние позвоночные сплетения впадают вены спинного мозга, а также vv. basivertebral, выходящие из тел позвонков на их задней поверхности и выносящие кровь из губчатого вещества позвонков. Наружные позвоночные сплетения, plexus venosi vertebrates externi , разделяются в свою очередь на два: переднее - на передней поверхности тел позвонков (развито главным образом в шейной и крестцовой областях), и заднее, лежащее на дугах позвонков, покрытое глубокими спинными и шейными мышцами. Кровь из позвоночных сплетений изливается в области туловища через vv. intervertebrales в vv. intercostales post, и vv. lumbales. В области шеи отток происходит главным образом в v. vertebralis, которая, идя вместе с a. vertebralis, вливается в v. brachiocephalica, самостоятельно или предварительно соединившись с v. cervicalis profunda.
Система нижней полой вены
V. cava inferior, нижняя полая вена , самый толстый венозный ствол в теле, лежит в брюшной полости рядом с аортой, вправо от нее. Она образуется на уровне IV поясничного позвонка из слияния двух общих подвздошных вен немного ниже деления аорты и тотчас направо от него. Нижняя полая вена направляется вверх и несколько вправо, так что чем дальше кверху, тем она больше отходит от аорты. Внизу вена прилежит у медиального края правого m. psoas, затем переходит на переднюю его поверхность и вверху ложится на поясничную часть диафрагмы. Затем, лежа в sulcus venae cavae на задней поверхности печени, нижняя полая вена проходит через foramen venae cavae диафрагмы в грудную полость и тотчас впадает в правое предсердие.
Притоки, впадающие прямо в нижнюю полую вену, соответствуют парным ветвям аорты (кроме vv. hepaticae). Они разделяются на пристеночные вены и вены внутренностей.
Пристеночные вены : 1) vv. lumbales dextrae et sinistrae , по четыре с каждой стороны, соответствуют одноименным артериям, принимают анастомозы из позвоночных сплетений; они соединяются между собой продольными стволами, vv. lumbales ascendentes; 2) vv. phrenicae inferiores впадают в нижнюю полую вену там, где она проходит в борозде печени.
Вены внутренностей : 1) vv. testiculares у мужчин (vv. ovaricae у женщин) начинаются в области яичек и оплетают одноименные артерии в виде сплетения (plexus pampiniformis); правая v. testicularis впадает непосредственно в нижнюю полую вену под острым углом, левая же - в левую почечную вену под прямым углом. Это последнее обстоятельство затрудняет, по Гиртлю, отток крови и обусловливает более частое появление расширения вен левого семенного канатика в сравнении с правым (у женщины v. ovarica начинается в воротах яичника); 2) vv. renales , почечные вены, идут впереди одноименных артерий, почти совершенно прикрывая их; левая длиннее правой и проходит впереди аорты; 3) v. suprarenalis dextra вливается в нижнюю полую вену тотчас выше почечной вены; v. suprarenalis sinistra обыкновенно не достигает полой вены и вливается в почечную вену впереди аорты; 4) vv. hepaticae , печеночные вены, впадают в нижнюю полую вену там, где она проходит по задней поверхности печени; печеночные вены выносят кровь из печени, куда кровь поступает через воротную вену и печеночную артерию (см. рис. 141).
Воротная вена
Воротная вена собирает кровь от всех непарных органов брюшной полости, за исключением печени: из всего желудочно-кишечного тракта, где происходит всасывание питательных веществ, которые поступают по воротной вене в печень для обезвреживания и отложения гликогена; из поджелудочной железы, откуда поступает инсулин, регулирующий обмен сахара; из селезенки, откуда попадают продукты распада кровяных элементов, используемые в печени для выработки желчи. Конструктивная связь воротной вены с желудочно-кишечным трактом и его крупными железами (печенью и pancreas) обусловлена, кроме функциональной связи, и общностью их развития (генетическая связь) (рис. 245).

V. portae, воротная вена , представляет толстый венозный ствол, расположенный в lig. hepatoduodenal вместе с печеночной артерией и ductus choledochus. Слагается v. portae позади головки поджелудочной железы из селезеночной вены и двух брыжеечных - верхней и нижней . Направляясь к воротам печени в упомянутой связке брюшины, она по пути принимает vv. gdstricae sinistra et dextra и v. prepylorica и в воротах печени разделяется на две ветви, которые уходят в паренхиму печени. В паренхиме печени эти ветви распадаются на множество мелких веточек, которые оплетают печеночные дольки (vv. interlobulares); многочисленные капилляры проникают в самые дольки и слагаются в конце концов в vv. centrales (см. "Печень"), которые собираются в печеночные вены, впадающие в нижнюю полую вену. Таким образом, система воротной вены в отличие от других вен вставлена между двумя сетями капилляров: первая сеть капилляров дает начало венозным стволам, из которых слагается воротная вена, а вторая находится в веществе печени, где происходит распадение воротной вены на ее конечные разветвления.
V. liertalis, селезеночная вена , несет кровь из селезенки, из желудка (через v. gastroepiploica sinistra и vv. gastricae breves) и из поджелудочной железы, вдоль верхнего края которой позади и ниже одноименной артерии она направляется к v. portae.
Vv. mesentericae superior et inferior, верхняя и нижняя брыжеечные вены , соответствуют одноименным артериям. V. mesenterica superior на своем пути принимает в себя венозные ветви от тонкой кишки (vv. intestinales), от слепой кишки, от восходящей ободочной и поперечной ободочной кишки (v. colica dextra et v. colica media) и, проходя позади головки поджелудочной железы, соединяется с нижней брыжеечной веной. V. mesenterica inferior начинается из венозного сплетения прямой кишки, plexus venosus rectalis. Направляясь отсюда вверх, она на пути принимает притоки из сигмовидной ободочной кишки (vv. sigmoideae), от нисходящей ободочной кишки (v. colica sinistra) и от левой половины поперечной ободочной кишки. Позади головки поджелудочной железы она, соединившись предварительно с селезеночной веной или самостоятельно, сливается с верхней брыжеечной веной.
Общие подвздошные вены
Vv. iliacae communes, общие подвздошные вены , правая и левая, сливаясь друг с другом на уровне нижнего края IV поясничного позвонка, образуют нижнюю полую вену. Правая общая подвздошная вена располагается сзади от одноименной артерии, левая же только внизу лежит позади одноименной артерии, затем ложится медиально от нее и проходит позади правой общей подвздошной артерии, чтобы слиться с правой общей подвздошной веной вправо от аорты. Каждая общая подвздошная вена на уровне крестцово-подвздошного сочленения в свою очередь слагается из двух вен: внутренней подвздошной (v. iliaca interna ) и наружной подвздошной (v. iliaca externa ).
Внутренняя подвздошная вена
V. iliaca interna, внутренняя подвздошная вена , в виде короткого, но толстого ствола располагается позади одноименной артерии. Притоки, из которых слагается внутренняя подвздошная вена, соответствуют одноименным артериальным ветвям, причем обычно вне таза эти притоки имеются в двойном числе; поступая же в таз, они становятся одиночными. В области притоков внутренней подвздошной вены образуется ряд венозных сплетений, анастомозирующих между собой.
1. Plexus venosus sacralis слагается из крестцовых вен - боковых и срединной.
2. Plexus venosus rectalis s. hemorrhoidalis (BNA) - сплетение в стенках прямой кишки. Различают три сплетения: подслизистое, подфасциальное и подкожное. Подслизистое, или внутреннее, венозное сплетение, plexus rectalis interims, в области нижних концов columnae rectalis представляет ряд венозных узелков, расположенных в виде кольца. Отводящие вены этого сплетения прободают мышечную оболочку кишки и сливаются с венами подфасциального, или наружного, сплетения, plexus rectalis externus. Из последнего выходит v. rectalis superior и vv. rectales mediae, сопровождающие соименные артерии. Первая посредством нижней брыжеечной вены вливается в систему воротной вены, вторые - в систему нижней полой вены, через внутреннюю подвздошную вену. В области наружного сфинктера заднего прохода образуется третье сплетение, подкожное - plexus subcutaneus ani, из которого составляются vv. rectales inferiores, вливающиеся в v. pudenda interna.
3. Plexus venosus vesicalis расположено в области дна мочевого пузыря; через посредство vv. vesicales кровь из этого сплетения изливается во внутреннюю подвздошную вену.
4. Plexus venosus prostaticus расположено между мочевым пузырем и лонным сращением, охватывая у мужчины предстательную железу и семенные пузырьки. В plexus venosus prostaticus вливается непарная v. dorsalis penis. У женщины дорсальной вене полового члена мужчины соответствует v. dorsalis clitoridis.
5. Plexus venosus uterinus и plexus venosus vaginalis женщины располагаются в широких связках по бокам матки и дальше книзу по боковым стенкам влагалища; кровь из них изливается отчасти через яичниковую вену (plexus pampiniformis), главным же образом через v. uterina во внутреннюю подвздошную вену.
Портокавальные и кавакавальные анастомозы

Корни воротной вены анастомозируют с корнями вен, относящихся к системам верхней и нижней полых вен, образуя так называемые портокавальные анастомозы, имеющие практическое значение.
Если сравнить брюшную полость с кубом, то эти анастомозы будут находиться на всех его сторонах, а именно:
1. Наверху, в pars abdominalis пищевода - между корнями v. gastricae sinistrae, впадающей в воротную вену, и vv. esophageae, впадающими в vv. azygos и hemyazygos и далее в v. cava superior.
2. Внизу, в нижней части прямой кишки, между v. rectalis superior, впадающей через v. mesenterica inferior в воротную вену, и vv. rectales media (приток v. iliaca interna) et inferior (приток v. pudenda interna), впадающих в v. iliaca interna и далее v. iliaca communis - из системы v. cava inferior.
3. Спереди, в области пупка, где своими притоками анастомозируют vv. paraumbilicales, идущие в толще lig. teres hepatis к воротной вене, v. epigastrica superior из системы v. cava superior (v. thoracica interna, v. brachiocephalica) и v. epigastrica inferior - из системы v. cava inferior (v. iliaca externa, v. iliaca communis).
Получается портокавальный и кавакавальный анастомозы, имеющие значение окольного пути оттока крови из системы воротной вены при возникновении препятствий для нее в печени (цирроз). В этих случаях вены вокруг пупка расширяются и приобретают характерный вид ("голова медузы") * .
* (Обширные связи вен зобной и щитовидной желез с венами окружающих органов участвуют в образовании кавакавальных анастомозов (Н. Б. Лихачева). )
4. Сзади, в поясничной области, между корнями вен мезоперитонеальных отделов толстой кишки (из системы воротной вены) и пристеночных vv. lumbales (из системы v. cava inferior). Все эти анастомозы образуют так называемую систему Ретциуса.
5. Кроме того, на задней брюшной стенке имеется кавакавальный анастомоз между корнями vv. lumbales (из системы v. cava inferior), которые связаны с парной v. lumbalis ascendens, являющейся началом vv. azygos (справа) et hemiazygos (слева) (из системы v. cava superior).
6. Кавакавальный анастомоз между vv. lumbales и межпозвонковыми венами, которые в области шеи являются корнями верхней полой вены.
Наружная подвздошная вена
V. iliaca externa является непосредственным продолжением v. femoralis, которая после прохождения под пупартовой связкой получает название наружной подвздошной вены. Идя медиально от артерии и позади нее, она в области крестцово-подвздошного сочленения сливается с внутренней подвздошной веной и образует общую подвздошную вену; принимает в себя два притока, впадающих иногда одним стволом: v. epigastrica inferior и v. circumflexa ilium profunda , сопровождающие одноименные артерии.
Вены нижней конечности . Как и на верхней конечности, вены нижней конечности разделяются на глубокие и поверхностные, или подкожные, которые проходят независимо от артерий.
Глубокие вены стопы и голени являются двойными и сопровождают одноименные артерии. V. poplitea, слагающаяся из всех глубоких вен голени, представляет одиночный ствол, располагающийся в подколенной ямке кзади и несколько латерально от одноименной артерии. V. femoralis, одиночная, вначале располагается латерально от одноименной артерии, затем постепенно переходит на заднюю поверхность артерии, а еще выше на ее медиальную поверхность, и в таком положении проходит под пупартовой связкой в lacuna vasorum. Притоки v. femoralis все двойные.
Из подкожных вен нижней конечности наиболее крупными являются два ствола: v. saphena magna и v. saphena parva. Vena saphena magna берет начало на дорсальной поверхности стопы из rete venosum dorsale pedis и arcus venosus dorsalis pedis. Получив несколько притоков со стороны подошвы, она направляется вверх по медиальной стороне голени и бедра. В верхней трети бедра она загибается на переднемедиальную поверхность и, лежа на широкой фасции, направляется к hiatus saphenus. В этом месте v. saphena magna вливается в бедренную вену, перекидываясь через нижний рог серповидного края. Довольно часто v. saphena magna бывает двойной, причем оба ее ствола могут вливаться отдельно в бедренную вену. Из других подкожных притоков бедренной вены следует упомянуть о v. epigastrica superficialis, v. circumflexa ilium superficialis, vv. pudendae externae, сопровождающих одноименные артерии. Они вливаются частью непосредственно в бедренную вену, частью в v. saphena magna у места ее впадения в области hiatus saphenus. V. saphena parva начинается на латеральной стороне дорсальной поверхности стопы, огибает снизу и сзади латеральную лодыжку и поднимается далее по задней поверхности голени; сначала она идет вдоль латерального края ахиллова сухожилия, а далее кверху по середине заднего отдела голени соответственно канавке между головками m. gastrocnemii. Достигнув нижнего угла подколенной ямки, v. saphena parva вливается в подколенную вену. V. saphena parva соединяется ветвями с v. saphena magna.
– градиент давления крови выше и ниже суженного участка сосуда;
– накопление в зоне ишемии БАВ с сосудорасширяющим действием (аденозина, ацетилхолина, Пг, кининов и др.);
– активация местных парасимпатических влияний (способствующих расширению коллатеральных артериол);
– высокая степень развития сосудистой сети (коллатералей)в поражённом органе или ткани.
Органы и ткани, в зависимости от степени развития артериальных сосудов и анастомозов между ними, делят на три группы:
– с абсолютно достаточными коллатералями: скелетная мускулатура, брыжейка кишечника, лёгкие. В них совокупный просвет коллатеральных сосудов равен или превышает диаметр магистральной артерии. В связи с этим, прекращение кровотока по ней не вызывает выраженной ишемии тканей в регионе кровоснабжения данной артерии;
– с абсолютно недостаточными коллатералями: миокард, почки, головной мозг, селезёнка. В этих органах суммарный просвет коллатеральных сосудов значительно меньше диаметра магистральной артерии. В связи с этим окклюзия её приводит к выраженной ишемии или инфаркту ткани.
– с относительно достаточными (или, что тоже самое: с относительно недостаточными) коллатералями: стенки кишечника, желудка, мочевого пузыря, кожа, надпочечники. В них совокупный просвет коллатеральных сосудов лишь незначительно меньше диаметра магистральной артерии.Окклюзия крупного артериального ствола в этих органах сопровождается большей или меньшей степенью их ишемии.
Стаз: типовая форма нарушения регионарного кровообращения, характеризующаяся значительным замедлением или прекращением тока крови и/или лимфы в сосудах органа или ткани.
Что такое коллатеральное кровообращение
Что такое коллатеральное кровообращение? Почему многие врачи и профессора акцентируют внимание на важном практическом значении этого вида кровотока? Закупорка вен может привести к полному блокированию передвижения крови по сосудам, поэтому организм начинает активно искать возможность поставки жидкой ткани боковыми путями. Именно такой процесс и называется – коллатеральное кровообращение.
Физиологические особенности организма дают возможность осуществлять поставку крови по сосудам, которые расположены параллельно основным. Такие системы имеют в медицине название – коллатерали, что с греческого языка переводится как «окольный». Эта функция позволяет при любых патологических изменениях, травмах, операционных вмешательствах обеспечивать бесперебойную подачу крови во все органы и ткани.
Виды коллатерального кровообращения
В организме человека коллатеральное кровообращение может иметь 3 вида:
- Абсолютное, или достаточное. В таком случае сумма коллатералей, которые будут медленно раскрываться, равна или приближена к магистралям основного сосуда. Такие боковые сосуды прекрасно заменяют патологически изменённые. Абсолютное коллатеральное кровообращение хорошо развито в кишечнике, лёгких и всех группах мышц.
- Относительное, или недостаточное. Такие коллатерали расположены в кожных покровах, желудке и кишечнике, мочевом пузыре. Они раскрываются медленнее, чем просвет у патологически изменённого сосуда.
- Недостаточное. Такие коллатерали неспособны полностью заменить основной сосуд и дать возможность крови полноценно функционировать в организме. Недостаточные коллатерали располагаются в головном мозге и сердце, селезёнке и почках.
Как показывает медицинская практика, развитие коллатерального кровообращения зависит от нескольких факторов:
- индивидуальных особенностей строения сосудистой системы;
- времени, за которое произошла закупорка основных вен;
- возраста больного.
Стоит понимать, что коллатеральное кровообращение лучше развивается и заменяет основные вены в молодом возрасте.
Как происходит оценка замены основного сосуда на коллатераль?
В случае если больному диагностировали серьёзные изменения в основных артериях и венах конечности, то врач делает оценку достаточности развития коллатерального кровообращения.
Чтобы дать правильную и точную оценку, специалист рассматривает:
- обменные процессы и их интенсивность в конечности;
- вариант лечения (операция, медикаменты и упражнения);
- возможность полного развития новообразующих путей для полноценного функционирования всех органов и систем.
Немаловажным является и место нахождения поражённого сосуда. Лучше будет производиться кровоток под острым углом отхождения ветвей кровеносной системы. Если выбрать тупой угол, то гемодинамика сосудов будет затруднена.
Многочисленные медицинские наблюдения показали, что для полноценного раскрытия коллатералей нужно блокировать рефлекторный спазм в нервных окончаниях. Такой процесс может появиться, поскольку при наложении на артерию лигатуры возникает раздражение нервных семантических волокон. Спазмы могут блокировать полное раскрытие коллатерали, поэтому таким больным проводят новокаиновую блокаду симпатических узлов.
SHEIA.RU
Коллатеральное Кровообращение
Роль и виды коллатерального кровообращения
Термин коллатеральное кровообращение подразумевает поступление крови по боковым ветвям в периферические отделы конечностей после перекрытия просвета магистрального (основного) ствола. Коллатеральный кровоток - важный функциональный механизм организма, обусловленный гибкостью кровеносных сосудов и отвечающий за бесперебойное кровоснабжение тканей и органов, помогающий выжить при инфаркте миокарда.
Роль коллатерального кровообращения
По сути коллатеральное кровообращение - это окольный боковой ток крови, который осуществляется по боковым сосудам. В физиологических условиях он совершается при затруднении нормального кровотока, или в патологических состояниях - ранения, закупорка, перевязка сосудов во время операции.
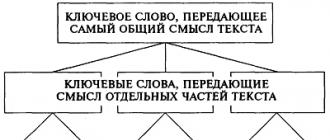
Самые крупные, берущие на себя роль выключенной артерии непосредственно после закупорки, называют анатомическими или предшествующими коллатералями.
Группы и виды
В зависимости от локализации межсосудистых анастомозов, предшествующие коллатерали делятся на следующие группы:
- Внутрисистемные - короткие пути окольного кровообращения, то есть, коллатерали, которые соединяют сосуды бассейна крупных артерий.
- Межсистемные - окольные или длинные пути, которые соединяют бассейны разных сосудов друг с другом.
Коллатеральное кровообращение подразделяется на виды:
- Внутриорганные соединения - межсосудистые соединения внутри отдельного органа, между сосудами мышц и стенками полых органов.
- Внеорганные соединения - соединения между ветвями артерий, питающих тот или иной орган или часть тела, а также между крупными венами.
На силу коллатерального кровоснабжения влияют следующие факторы: угол отхождения от главного ствола; диаметр артериальных ветвей; функциональное состояние сосудов; анатомические особенности боковой предшествующей ветви; количество боковых ветвей и вид их ветвления. Важным моментом для объёмного кровотока является то, в каком состоянии находятся коллатерали: в расслабленном или спазмированном. Функциональный потенциал коллатералей определяет регионарное периферическое сопротивление и общая региональная гемодинамика.
Анатомическое развитие коллатералей
Коллатерали могут существовать как в обычных условиях, так и вновь развиваться при образовании анастомозов. Таким образом, расстройство обычного кровоснабжения, вызванное каким-либо препятствием на пути кровяного потока в сосуде, включает уже существующие кровеносные обходные пути, а после этого начинают развиваться новые коллатерали. Это приводит к тому, что кровь успешно минует участки, в которых нарушена проходимость сосудов и нарушенное кровообращение восстанавливается.
Коллатерали можно разделить на следующие группы:
- достаточно развитые, для которых характерно широкое развитие, диаметр их сосудов такой же, как и диаметр основной артерии. На кровообращении такой области мало отражается даже полное перекрытие основной артерии, та как анастомозы замещают в полном объёме снижение кровяного притока;
- недостаточно развитые находятся в органах, где внутриорганные артерии между собой мало взаимодействуют. Их принято называть кольцевыми. Диаметр их сосудов намного меньше диаметра основной артерии.
- относительно развитые частично компенсируют нарушенное кровообращение в ишемизированнойобласти.
Диагностика
Чтобы диагностировать коллатеральное кровообращение, прежде всего нужно учесть скорость обменных процессов в конечностях. Зная данный показатель и грамотно на него воздействуя при помощи физических, фармакологических и хирургических методов, можно поддерживать жизнеспособность органа или конечности и стимулировать развитие новообразующихся путей кровяного потока. Для этого нужно уменьшить потребление тканями кислорода и питательных веществ, поступающих с кровью, либо активизировать коллатеральное кровообращение.
Кровоток коллатерального типа что это
Клиническая и топографическая анатомия изучают и такой важный вопрос, как коллатеральное кровообращение. Коллатеральное (окольное) кровообращение существует в физиологических условиях при временных затруднениях кровотока по магистральной артерии (например, при сдавлении сосудов в местах движения, чаще всего в области суставов). В физиологических условиях коллатеральное кровообращение осуществляется по уже существующим сосудам, идущим параллельно основным. Эти сосуды называются коллатералями (например, a. collateralis ulnaris superior и др.), отсюда название кровотока - «коллатеральное кровообращение».
Коллатеральный кровоток может возникнуть и в патологических условиях - при закупорке (-окклюзии), частичном сужении (стенозе), повреждениях и перевязке сосудов. При затруднении или прекращении кровотока по основным сосудам кровь устремляется по анастомозам в ближайшие боковые ветви, которые расширяются, делаются извитыми и постепенно соединяются (анас-томозируют) с существующими коллатералями.
Таким образом, коллатерали существуют и в обычных условиях и могут развиваться вновь при наличии анастомозов. Следовательно, при расстройстве обычного кровообращения, вызванном препятствием на пути тока крови в данном сосуде, сначала включаются существующие обходные кровеносные пути, коллатерали, а затем развиваются новые. В результате кровь обходит участок с нарушением проходимости сосуда и кровообращение дистальнее этого участка восстанавливается.
Для понимания коллатерального кровообращения необходимо знать те анастомозы, которые соединяют между собой системы различных сосудов, по которым устанавливается коллатеральный ток крови в случае их ранения и перевязки или при развитии патологического процесса, ведущего к закупорке сосуда (тромбоз и эмболия).
Анастомозы между ветвями крупных артериальных магистралей, снабжаюших основные части тела (аорта, сонные артерии, подключичные, подвздошные артерии и др.) и представляющих как бы отдельные системы сосудов, называются межсистемными . Анастомозы между ветвями одной крупной артериальной магистрали, ограничивающиеся пределами ее разветвления, называются внутрисистемными.
Не менее важны анастомозы между системами крупных вен, таких как нижняя и верхняя полые вены, воротная вена. Изучению анастомозов, соединяющих эти вены (каво-кавальные, портока-вальные анастомозы), в клинической и топографической анатомии уделяется большое внимание.
Будем рады вашим вопросам и отзывам:
Материалы для размещения и пожелания просим присылать на адрес
Присылая материал для размещения вы соглашаетесь с тем, что все права на него принадлежат вам
При цитировании любой информации обратная ссылка на MedUniver.com - обязательна
Вся предоставленная информация подлежит обязательной консультации лечащим врачом
Администрация сохраняет за собой право удалять любую предоставленную пользователем информацию
УЗИ сканер, допплер: Ультразвуковая допплерография нижних конечностей
Портативный УЗИ сканер с цветным и энергетическим допплером
Ультразвуковая допплерография нижних конечностей
- (Избранная глава из Учебно-методического руководства " КЛИНИЧЕСКАЯ ДОППЛЕРОГРАФИЯ ОККЛЮЗИРУЮЩИХ ПОРАЖЕНИЙ АРТЕРИЙ МОЗГА И КОНЕЧНОСТЕЙ ". Е.Б. Куперберг (ред.) А.Э. Гайдашев и др.)
1. Анатомо - физиологические особенности строения системы артерий нижних конечностей
Внутренняя подвздошная артерия (ВПА) кровоснабжает органы малого таза, промежность, половые органы, ягодичные мышцы.
Наружная подвздошная артерия (НПА) кровоснабжает тазобедренный сустав и головку бедренной кости. Непосредственным продолжением НПА является бедренная артерия (БА), отходящая от НПА на уровне средней трети паховой связки.
Наиболее крупной ветвью БА является глубокая артерия бедра (ГАБ). Ей принадлежит основная роль в кровоснабжении мышц бедра.
Продолжением БА является подколенная артерия (ПклА), которая начинается на 3-4 см выше медиального надмыщелка бедренной кости и заканчивается на уровне шейки малоберцовой кости. Длина ПклА составляет примерносм.
Рис.82. Схема строения артериальной системы верхних и нижних конечностей.
Передняя тибиальная артерия, отделившись от подколенной, идет вдоль нижнего края подколенной мышцы до промежутка, образованного ею с шейкой малоберцовой кости снаружи и задней большеберцовой мышцей - снизу.
Дистальнее ПТА оказывается в средней трети голени между длинным разгибателем большого пальца и передней большеберцовой мышцей. На стопе ПТА продолжается в тыльную артерию стопы (терминальная ветвь ПТА).
Задняя тибиальная артерия является непосредственным продолжением ПклА. Позади медиальной лодыжки, на середине расстояния между ее задним краем и медиальным краем ахиллова сухожилия она переходит на основание стопы. От ЗТА в средней трети голени отходит малоберцовая артерия, кровоснабжающая мышцы голени.
Таким образом, прямым источником кровоснабжения нижней конечности является НПА, ниже пупартовой связки переходящая в бедренную, и три сосуда обеспечивают кровоснабжение голени, из которых два (ПТА и ЗТА) кровоснабжают стопу (рис. 82).
Коллатеральное кровообращение при поражении артерий нижних конечностей
Окклюзирующие поражения различных сегментов артериальной системы нижних конечностей, как и любых других артериальных систем, приводят к развитию компенсаторного коллатерального кровообращения. Анатомические предпосылки его развития заложены в самом строении артериальной сети нижней конечности. Различают внутрисистемные анастомозы, то есть анастомозы, соединяющие ветви одной крупной артерии, и межсистемные, то есть анастомозы между ветвями различных сосудов.
При поражении НПА в любом участке до уровня отхождения двух ее ветвей - нижней надчревной и глубокой, окружающей подвздошную кость, коллатеральное кровоснабжение осуществляется через межсистемные анастомозы между ветвями этих артерий и ВПА (подвздошно-поясничная, запирательная, поверхностная и глубокая ягодичные артерии)(рис. 83).
Рис.83. Окклюзия правой НПА с заполнением БА через коллатерали.
При поражении БА ветви ГБА широко анастомозируют с проксимальными ветвями ПклА и составляют наиболее важный окольный путь (рис. 84).
При поражении ПклА важнейшие межсистемные анастомозы образуются между ее ветвями и ПТА (сеть коленного сустава). Кроме того, ветви ПклА к задней группе мышц голени и ее ветви к коленному суставу образуют богатую коллатеральную сеть с ветвями ГБА. Тем не менее, коллатеральные перетоки в системе ПклА не столь полноценно осуществляют компенсацию кровообращения, как в системе БА, поскольку коллатеральная компенсация в любой из сосудистых систем при дистальных ее поражениях всегда менее эффективна, чем при проксимальных (рис. 85).
Рис.84. Окклюзия правой БА в средней трети с коллатеральным перетоком через ветви ГАБ (a) и заполнением подколенной артерии (b).
Рис.85. Дистальное поражение артерий голени с плохой коллатеральной компенсацией.
Этому же правилу отвечает коллатеральная компенсация при поражении тибиальных артерий. Широко через планетарную дугу анастомозируют на стопе терминальные ветви ЗТА и ПТА. В стопе тыльная поверхность кровоснабжается конечными ветвями передней, а подошвенная поверхность- ветвями задней тибиальных артерий, между ними существуют многочисленные перфорантные артерии, осуществляющие необходимую компенсацию кровообращения при поражении одной из тибиальных артерий. Тем не менее, дистальное поражение ветвей ПклА часто приводит к тяжелой ишемии, трудно поддающейся лечению.
Выраженность ишемии нижней конечности определяется, с одной стороны, уровнем окклюзии (чем выше уровень окклюзии, тем более совершенно коллатеральное кровообращение) и, с другой стороны, степенью развития коллатерального кровообращения при одинаковом уровне поражения.
2. Методика обследования артерий нижних конечностей
Обследование больных методом УЗДГ проводится с помощью датчиков с частотами 8 МГц (ветви ПТА И ЗТА) и 4 МГц (БА и ПклА).
Методику обследования артерий нижних конечностей можно условно разбить на два этапа. Первым этапом проводится локация кровотока в стандартных точках с получением информации о его характере, вторым этапом - измерение регионарного артериального давления с регистрацией индексов давления.
Локация в стандартных точках
Практически на всем протяжении артерии нижних конечностей трудно доступны для локации из-за большой глубины залегания. Существуют несколько проекций точек пульсации сосудов, где локация кровотока легко доступна (рис. 86).
К ним относятся:
- первая точка в проекции скарповского треугольника, на один поперечный палец медиальнее середины пупартовой связки (точка наружной подвздошной артерии); вторая точка в области подколенной ямки в проекции ПклА; третья точка локализована в ямке, образованной спереди медиальной лодыжкой, а сзади ахилловым сухожилием (ЗТА);
- четвертая точка в области тыла стопы вдоль линии между первой и второй фалангами (терминальная ветвь ПТА).
Рис.86. Стандартные точки локации и допплерограммы артерий нижних конечностей.
Локация кровотока в двух последних точках может иногда представлять некоторое затруднение из-за вариабельности хода артерий на стопе и лодыжке.
При локации артерий нижних конечностей в норме допплерограммы имеют трехфазную кривую, характеризующую обычный магистральный кровоток (рис. 87).
Рис.87. Допплерограмма магистрального кровотока.
Первый антеградный остроконечный высокий пик характеризует систолу (систолический пик), второй ретроградный небольшой пик возникает в диастолу вследствие ретроградного тока крови в сторону сердца до момента закрытия аортального клапана, третий антеградный небольшой пик возникает в конце диастолы и объясняется возникновением слабого антеградного кровотока после отражения крови от створок аортального клапана.
При наличии стеноза выше или в месте локации, как правило, определяется измененный магистральный кровоток, который характеризуется двухфазной амплитудой допплеровского сигнала (рис. 88).
Рис.88. Допплерограмма измененного магистрального кровотока.
Систолический пик более пологий, основание его расширено, ретроградный пик может быть не выражен, но все же чаще всего присутствует, нет третьего антеградного пика.
Ниже уровня окклюзии артерии регистрируется коллатеральный тип допплерограмм, который характеризуется значительным изменением систолического пика и отсутствием как ретроградного, так и второго антеградного пиков. Этот тип кривой может быть назван монофазным (рис. 89).
Рис.89. Допплерограмма коллатерального кровотока.
Измерение регионарного давления
Величина артериального систолического давления, как интегрального показателя, определяется суммой потенциальной и кинетической энергии, которой обладает масса крови, движущаяся на определенном участке сосудистой системы. Измерение артериального систолического давления методом УЗДГ представляет собой, в сущности, регистрацию первого тона Короткова, когда давление, создаваемое пневматической манжетой, становится ниже артериального давления на данном участке артерии так, что появляется минимальный кровоток.
Для измерения регионарного давления в отдельных сегментах артерий нижней конечности необходимо иметь пневматические манжеты, по сути такие же, как для измерения артериального давления на руке. Перед началом измерения определяется артериальное давления в плечевой артерии, а затем в четырех точках артериальной системы нижней конечности (рис. 90).
Стандартное расположение манжет следующее:
- первая манжета накладывается на уровне верхней трети бедра; вторая - в нижней трети бедра; третья - на уровне верхней трети голени;
- четвертая - на уровне нижней трети голени;
Рис.90. Стандартное расположение пневматических манжет.
Суть измерения регионарного давления состоит в регистрации первого тона Короткова при последовательном раздувании манжет:
- первая манжета предназначена для определения систолического давления в проксимальном отделе БА; вторая - в дистальном отделе БА; третья - в ПклА;
- четвертая - в артериях голени.
При регистрации АД на всех уровнях нижних конечностей локацию кровотока удобно проводить в третьей или четвертой точках. Появление тока крови, регистрируемого датчиком при постепенном снижении давления воздуха в манжете, является моментом фиксации систолического АД на уровне ее наложения.
При наличии гемодинамически значимого стеноза или окклюзии артерии, АД снижается в зависимости от степени стеноза, а при окклюзии степень его снижения определяется выраженностью развития коллатерального кровообращения. Артериальное давление на ногах в норме выше, чем на верхних конечностях примерно намм.рт.ст.
Топическое значение измерения артериального давления на ногах определяется последовательным измерением этого показателя над каждым из артериальных сегментов. Сопоставление цифр артериального давления дает достаточное представление о состоянии гемодинамики в конечности.
Большей объективизации измерения способствует вычисление т.н. индексов, то есть относительных показателей. Наиболее часто используется лодыжечный индекс давления (ЛИД), рассчитываемый как отношение артериального систолического давления в ПТА и/или в ЗТА к этому показателю в плечевой артерии:
Например, АД на лодыжке равно 140 мм.рт.ст., а на плечевой артериимм.рт.ст., следовательно, ЛИД = 140/110 = 1.27.
При допустимом градиенте артериального давления в плечевых артериях (до 20 мм.рт.ст.), АДп берется по большему показателю, а при гемодинамически значимом поражении обеих подключичных артерий значение ЛИД падает. В этом случае большее значение приобретают абсолютные цифры артериального давления и его градиенты между отдельными сосудистыми сегментами.
В норме ЛИД составляет от 1.0 до 1.5 на любом уровне.
Максимальное колебание ЛИД от верхней до нижней манжеты составляет не более 0.2- 0.25 в ту или иную сторону. ЛИД ниже 1.0 указывает на поражение артерии проксимальнее или в месте измерения.
Схема обследования артерий нижних конечностей
Больной находится в положении на спине (за исключением обследования ПклА, которая лоцируется при положении больного на животе).
Первым этапом проводится измерение артериального давления на обеих верхних конечностях.
Второй этап заключается в последовательной локации стандартных точек с получением и регистрацией допплерограмм НПА, БА, ПТА и ЗТА.
Следует отметить необходимость применения контактного геля, особенно при локации тыльной артерии стопы, где довольно тонкий подкожно-жировой слой, и локация без создания своеобразной «подушки» из геля может быть затруднена.
Частота ультразвукового датчика зависит от лоцируемой артерии: при локации наружной подвздошной и бедренной артерий целесообразно применение датчика частотой 4-5 МГц, при локации более мелких ЗТА и ПТА - частотой 8-10 МГц. Установка датчика должна быть такой, чтобы артериальный кровоток был направлен на него.
Для проведения третьего этапа исследования на стандартные участки нижней конечности (см. предыдущий раздел) накладываются пневматические манжеты. Для измерения артериального давления (с последующим пересчетом на ЛИД) в НПА и БА, регистрация может проводится в 3 или 4 точках на стопе, при измерении артериального давления в артериях голени - последовательно в обеих 3 и 4 точках. Измерение АД на каждом уровне проводится трижды с последующим выбором максимального значения.
3. Диагностические критерии окклюзирующих поражений артерий нижних конечностей
При постановке диагноза окклюзирующего поражения артерий нижних конечностей методом УЗДГ одинаковую роль имеют и характер кровотока при прямой локации артерий, и регионарное артериальное давление. Только совокупная оценка обоих критериев позволяет установить точный диагноз. Тем не менее, характер кровотока (магистральный или коллатеральный) все же более информативный критерий, поскольку при хорошо развитом уровне коллатерального кровообращения значения ЛИД могут быть достаточно высокими и ввести в заблуждение относительно поражения артериального сегмента.
Изолированное поражение отдельных сегментов артериальной сети нижней конечности
При умеренно выраженном стенозе, не достигающем гемодинамической значимости (от 50 до 75%), кровоток в данном артериальном сегменте имеет измененный магистральный характер, проксимальнее и дистальнее (например, для БА проксимальный сегмент - НПА, дистальный - ПклА) характер кровотока магистральный, значения ЛИД не изменяются на всем протяжении артериальной системы нижней конечности.
Окклюзия терминального отдела аорты
При окклюзии терминального отдела аорты во всех стандартных точках локации на обеих конечностях регистрируется кровоток коллатерального характера. На первой манжете ЛИД снижен более, чем на 0.2-0.3, на остальных манжетах колебания ЛИД не более 0.2 (рис. 91).
Дифференцировать уровень поражения аорты возможно только ангиографически и по данным дуплексного сканирования.
Рис.91. Окклюзия брюшной аорты на уровне отхождения почечных артерий.
Изолированная окклюзия наружной подвздошной артерии
При окклюзии НПА в стандартных точках локации регистрируется кровоток коллатерального характера. На первой манжете ЛИД снижен более чем на 0.2-0.3, на остальных манжетах колебания ЛИД не более 0.2 (рис. 92).
Изолированная окклюзия бедренной артерии
в сочетании с поражением ГАБ
При окклюзии БА в сочетании с поражением ГАБ в первой точке регистрируется магистральный кровоток, в остальных - коллатеральный. На первой манжете ЛИД снижен более значительно в связи с выключением из коллатеральной компенсации ГАБ (ЛИД может снизиться более чем на 0.4-0.5), на остальных манжетах колебания ЛИД не более 0.2 (рис. 93).
Изолированная окклюзия бедренной артерии ниже отхождения ГАБ
При окклюзии БА ниже уровня отхождения ГАБ (проксимальная или средняя треть) в первой точке регистрируется магистральный кровоток, в остальных - коллатеральный, также как при окклюзии БА и ГАБ, но снижение ЛИД может быть не таким значительным, как в предыдущем случае, а дифференциальный диагноз с изолированным поражением НПА проводится на основании характера кровотока в первой точке (рис. 94).
Рис.94. Изолированная окклюзия БА в средней или дистальной трети
При окклюзии средней или дистальной трети БА в первой точке - магистральный кровоток, в остальных - коллатеральный тип, при этом ЛИД на первой манжете не изменен, на второй - снижен более чем на 0.2-0.3, на остальных - колебания ЛИД не более 0.2 (рис. 95).
Рис.95. Изолированная окклюзия ПклА
При окклюзии ПклА в первой точке регистрируется магистральный кровоток, в остальных - коллатеральный, при этом ЛИД на первой и второй манжете не изменен, на третьей - снижен более чем на 0.3- 0.5, на четвертой манжете ЛИД примерно такой же, как на третьей (рис. 96).
Изолированная окклюзия артерий голени
При поражении артерий голени кровоток не изменен в первой и второй стандартных точках, на третьей и четвертой точках - кровоток коллатеральный. Лодыжечный индекс давления не изменяется на первой, второй и третьей манжетах и резко снижается на четвертой на 0.5 -0.7, вплоть до величины индекса 0.1 -0.2 (рис. 97).
Сочетанное поражение сегментов артериальной сети нижней конечности
Более сложна интерпретация данных при сочетанном поражении артериальной сети нижней конечности.
Прежде всего определяется скачкообразное снижение ЛИД (более 0.2-0.3) ниже уровня каждого из поражений.
Во- вторых, возможна своеобразное «суммирование» стенозов при тандемном (двойном) гемодинамически значимом поражении (например, НПА и БА), при этом в более дистальном сегменте может регистрироваться коллатеральный кровоток, свидетельствующий об окклюзии. Поэтому необходимо тщательно анализировать полученные данные с учетом обоих критериев.
Окклюзия НПА в сочетании с поражением БА и периферического русла
При окклюзии НПА в сочетании с поражением БА и периферического русла в стандартных точках локации регистрируется кровоток коллатерального характера. На первой манжете ЛИД снижен более чем на 0.2-0.3, на второй манжете ЛИД снижается также более чем на 0.2-0.3 по сравнению с первой манжетой. На третьей манжете перепад ЛИД в сравнении со второй не более 0.2, на четвертой манжете вновь регистрируется перепад ЛИД более 0.2 -0.3 (рис. 98).
Окклюзия БА в средней трети в сочетании с поражением периферического русла
При окклюзии БА в средней трети в сочетании с поражением периферического русла в первой точке определяется магистральный, на всех остальных уровнях - коллатеральный кровотоки со значимым градиентом между первой и второй манжетами, на третьей манжете снижение ЛИД по сравнению со второй незначимо, а на четвертой манжете вновь происходит значимое снижение ЛИД вплоть до 0.1-0.2 (рис. 99).
Окклюзия ПклА в сочетании с поражением периферического русла
При окклюзии ПклА в сочетании с поражением периферического русла характер кровотока не изменен в первой стандартной точке, во второй, третьей и четвертой точках - кровоток коллатеральный. Лодыжечный индекс давления не изменяется на первой и второй манжетах и резко снижается на третьей и четвертой на 0.5 -0.7 вплоть до величины индекса 0.1 -0.2.
Нечасто, но одновременно с ПклА поражаются не обе, а одна ее из ветвей. В этом случае дополнительное поражение этой ветви (ЗТА или ПТА) может быть определено раздельным измерением ЛИД на каждой из ветвей в 3 и 4 точках (рис. 100).
Таким образом, при сочетанных поражениях артерий нижней конечности возможны разнообразные варианты, однако тщательное соблюдение протокола исследования позволит избежать возможные ошибки в постановке диагноза.
Также задаче более точной постановки диагноза отвечает автоматизированная экспертно- диагностическая система определения патологии артерий нижних конечностей “ЭДИССОН”, позволяющая на основании объективных показателей градиента давления определять уровень поражения этих артерий.
4. Показания к хирургическому лечению
Показания к реконструкции аорто-подвздошного, аорто-бедренного, подвздошно-бедренного и бедренно-подколенного сегментов артерий нижних конечностей
Показания к реконструктивным операциям на артериях нижних конечностях при поражении аорто-бедренно-подколенной зон достаточно широко освещены в отечественной и зарубежной литературе, и подробное изложение их нецелесообразно. Но, вероятно, следует напомнить основные их пункты.
На основании клинических, гемодинамических и артериографических критериев разработаны следующие показания для реконструкции:
Градация I : выраженная перемежающая хромота у активного индивидуума, отрицательно влияющая на трудоспособность, отсутствие возможности изменить стиль жизни при адекватной оценке пациентом риска операции (хроническая ишемия н/конечностей 2Б-3 ст, снижающая качество жизни пациента);
В целом, показания к оперативному лечению устанавливаются индивидуально, в зависимости от возраста, сопутствующих заболеваний и образа жизни пациента. Так, клиника перемежающей хромоты даже черезметров без болей в покое и без трофических нарушений еще не является показанием к операции, если эта ситуация не снижает «качество жизни» пациента (например, передвижение преимущественно автомобилем, умственный труд). Существует и прямо противоположная ситуация, когда перемежающая хромота через метров, но с учетом специальности пациента (например, занятость в сфере тяжелого физического труда) делает его нетрудоспособным и дает показания к хирургической реконструкции. Однако в любом случае хирургической реконструкции должно предшествовать медикаментозное лечение, включающее наряду с вазоактивными и дезагрегантными препаратами отказ от курения, антихолестериновую низкокалорийную диету.
Градация II : боли в покое, не поддающиеся нехирургическому консервативному лечению (хроническая ишемия н/конечностей 3 ст, психоастения);
Градация III : незаживающая язва или гангрена, обычно ограниченная пальцами или пяткой или тем и другим. Ишемические боли в покое и/или тканевые некрозы, включая ишемические язвы или свежую гангрену являются показаниями для операции, если для этого существуют соответствующие анатомические условия. Возраст редко выступает как причина противопоказаний к реконструкции. Даже престарелым пациентам может быть проведено наряду с медикаментозным лечением ТЛБАП, если хирургическая реконструкция невозможна в связи с соматическим состоянием пациента.
Показания при градации I предназначены для функционального улучшения, градации II и III - для спасения нижней конечности.
Частота атеросклеротического поражения артерий нижних конечностей различна (рис. 101). Наиболее частой причиной хронической ишемии является поражение бедренно-подколенной (50%) и аорто-подвздошной зон (24%).
Виды операций, применяемые для оперативного лечения хронической ишемии нижних конечностей крайне разнообразны. Основную массу их составляют т.н. шунтирующие операции, основным смыслом которых является создание обходного шунта (bypass) между неизмененными участками сосудистого русла выше и ниже зоны артериального поражения.
Рис.101. Частота атеросклеротических поражений артерий нижних конечностей.
1- аорто-подвздошная, 2- бедренно-подколенная, 3- тибиальная,
4- подвздошно-бедренная, 5- подколенная зоны.
В соответствии с частотой поражения артерий нижних конечностей, наиболее часто выполняемыми операциями являются бедренно-подколенное шунтирование (рис. 102) и аорто-бедренное бифуркационное (рис. 103а) или одностороннее (рис. 103б) шунтирования. Другие операции прямой и непрямой реваскуляризации артерий нижних конечностей выполняются значительно реже.
Рис.102. Схема операции бедренно-подколенного шунтирования.
B Рис.103. Аорто-бедренное бифуркационное (а) и одностороннее (б)
Транслюминальная баллонная ангиопластика артерий нижних конечностей
Как и все методы лечения сосудистых заболеваний, показания к применению ТЛБАП базируются на клинических и морфологических критериях. Безусловно, ТЛБАП показана только для «симптомных» больных, то есть для тех, у которых поражение артериального русла нижних конечностей сопровождается развитием симптомов ишемии разной степени выраженности - от перемежающей хромоты до развития гангрены конечности. В то же время, если для хирургической реконструкции (см. предыдущий раздел) показания строго определены только для выраженной ишемии, а при перемежающей хромоте вопрос решается индивидуально, то для ТЛБАП клинические показания могут быть представлены значительно шире из-за меньшего риска осложнений и летальности.
Серьезные осложнения при хирургическом лечении случаются тоже весьма редко, но тем не менее риск осложнений при ТЛБАП, при соблюдении всех условий процедуры и правильно установленных показаниях, еще ниже. Поэтому клинические показания к ТЛБАП должны не только включать пациентов с критической ишемией нижних конечностей (боли в покое или артериальные ишемические язвы, начинающаяся гангрена), но и больных с перемежающей хромотой, снижающей качество жизни.
Анатомические показания для ТЛБАП: идеальные:
- короткий стеноз брюшной аорты (рис. 104); короткий стеноз, захватывающий бифуркацию аорты включая устья общих подвздошных артерий; короткий стеноз подвздошной артерии и короткая окклюзия подвздошной артерии (рис.105); короткий одиночный или множественный стеноз поверхностной бедренной артерии (рис.106а) или ее окклюзия менее 15 см (рис. 106б);
- короткий стеноз подколенной артерии (рис. 107).
Рис.104. Ангиограмма стеноза артерии.
Рис.105. Ангиограмма стеноза подвздошной брюшной аорты (стрелка).
B Рис.106а. Ангиограммы стеноза (а) и окклюзии (б) БА до и после ТЛБАП.
Рис.107. Ангиограмма стеноза подколенной артерии.
Часть типов поражения могут также подвергаться ТЛБАП, но с более низкой эффективностью, чем в группе «идеальных» больных:
- пролонгированный стеноз общей подвздошной артерии;
- короткие стенозы ветвей подколенной артерии ниже коленного сустава.
Однако, пролонгированные стенозы в НПА и нециркулярные пролонгированные стенозы брюшной аорты могут быть показаны для ТЛБАП, если есть серьезные противопоказания для хирургической реконструкции, хотя следует еще раз подчеркнуть, что эффективность ближайшего и отдаленного периодов могут быть снижены.
Противопоказания базируются на анатомических особенностях, однако они должны быть всегда оценены в свете риска ТЛБАП в соотношении с альтернативными процедурами (хирургическое или медикаментозное лечение).
Следующие ситуации могут сопровождаться низкой эффективностью и, главное, высоким риском осложнений при ТЛБАП:
- пролонгированная окклюзия подвздошной артерии при ее извитости; окклюзия подвздошной артерии, но которая клинически и/или ангиографически может быть заподозрена как тромбоз;
- наличие аневризм, особенно подвздошных и почечных артерий.
В ряде случаев (относительно недавняя окклюзия) эффективность может принести направленная тромболитическая терапия, применение которой целесообразно до ТЛБАП.
При наличии отложений кальция в месте стеноза, ТЛБАП может быть рискована из-за возможной диссекции или разрыва артерии. Однако, применение транслюминальной атеротомии расширило возможности метода и сделало его реальным и при этих ситуациях.
Важным аспектом применения ТЛБАП является возможность комбинации этого метода с хирургическим лечением, в том числе:
- ТЛБАП стеноза подвздошной артерии перед бедренно-подколенным шунтированием или другими дистальными процедурами; ТЛБАП рестенозов;
- ТЛБАП действующих шунтов, но при узком нитевидном просвете последних.
Таким образом, ТЛБАП может быть применена или как альтернатива хирургическому лечению, или в качестве помощи этому виду лечения, или может быть применена до или после хирургического лечения у селективно отобранной группы больных.
Портативный УЗИ сканер с цветным и энергетическим допплером LogicScan. Подключение к любому персональному компьютеру по USB!
Коллатерали развиваются из ранее существовавших анатомических каналов (тонкостенные структуры с диаметром от 20 до 200 нм), в результате образования градиента давления между их началом и окончанием и химических медиаторов, высвобождаемых во время гипоксии тканей. Процесс называется артериогенезом. Показано, что градиент давления около 10 мм рт.ст. достаточен для развития коллатерального кровотока. Межартериальные коронарные анастомозы представлены в разном количестве у разных видов: они так многочисленны у морских свинок, что могут предотвратить развитие ИМ после внезапной коронарной окклюзии, тогда как фактически отсутствуют у кроликов.
У собак плотность анатомических каналов может составлять 5-10% предокклюзионного кровотока в покое. У человека имеется немного хуже развитая система коллатерального кровообращения, чем у собак, но выраженная межиндивидуальная вариабельность.
Артериогенез происходит в три этапа:
- первая стадия (первые 24 ч) характеризуется пассивным расширением уже существовавших каналов и активацией эндотелия после секреции протеолитических ферментов, которые разрушают экстрацелюллярный матрикс;
- вторая стадия (от 1 дня до 3 нед) характеризуется миграцией моноцитов в стенку сосудов после секреции цитокинов и факторов роста, которые запускают пролиферацию эндотелиальных и гладкомышечных клеток и фибробластов;
- третья фаза (3 нед до 3 мес) характеризуется утолщением сосудистой стенки в результате отложения экстрацеллюлярного матрикса.
В финальной стадии зрелые коллатералльные сосуды могут достигать до 1 мм в диаметре просвета. Тканевая гипоксия может благоприятствовать развитию коллатералей путем воздействия на промоторный ген фактора роста эндотелия сосудов, но это не основное требование к развитию коллатералей. Из факторов риска диабет может снижать способность к развитию коллатеральнх сосудов.
Хорошо развитое коллатеральное кровообращение может успешно предотвращать ишемию миокарда у человека при внезапной окклюзии коллатералей, но редко обеспечивает адекватный кровоток в соответствии с потребностями миокарда в кислороде во время максимальных физических нагрузок.
Коллатеральные сосуды могут также образовываться путем ангиогенеза, который заключается в формировании новых сосудов из уже существующих и обычно приводит к образованию структур, подобных капиллярной сети. Это было четко продемонстрировано при изучении имплантатов грудной артерии в миокарде собак с постепенной полной окклюзией основной венечной артерии. Коллатеральное кровоснабжение, обеспечиваемое такими вновь образованными сосудами, весьма невелико по сравнению с кровоснабжением, обеспеченным в результате артериогенеза.
Filippo Crea, Paolo G. Camici, Raffaele De Caterina и Gaetano A. Lanza
Хроническая ишемическая болезнь сердца